生物于2月24日午間發布公告稱,與軍事科學院軍事醫學研究院生物工程研究所共同開發的重組新型冠狀病毒疫苗(5型腺病毒載體)(「Ad5-nCoV」,商品名為克威莎)附條件上市申請獲國家藥監局受理。這意味著Ad5-nCoV在國內獲批只差最后一步,待國家藥監局審批后疫苗即可正式上市。
在國內,從新藥上市申請及相關資料遞送并獲得受理通知書之日起算,大約需要6-8個月完成審評事項并發布藥品上市許可。但在發生突發公共衛生事件時,應急處理所需的新藥可以按照特別審批程序辦理。為了疫情防控,國家藥監局今年緊急開辟了藥品醫療器械應急審批的綠色通道,來保證應急防控物資需要以及防疫所需的藥品和醫療器械。的新冠檢測試劑盒審批用時僅4天;科興中維的新冠疫苗從2月3日提交上市注冊申請到獲批,僅用了2天時間。而在國藥集團宣布新冠疫苗上市申請獲受理后,國藥相關個股午后大幅拉升,(600511.SH)大漲6.90%。
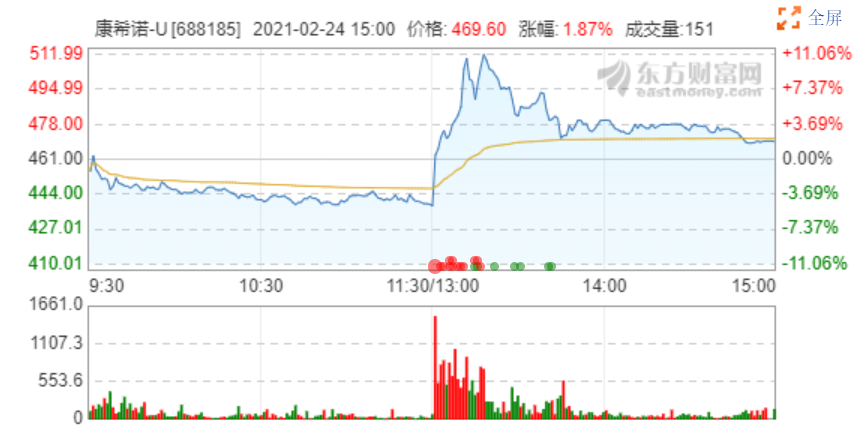
康希諾2月24日股價變化
公告中稱,該疫苗在巴基斯坦、墨西哥、俄羅斯、智利及阿根廷5個國家開展了全球多中心Ⅲ期臨床研究,已完成4萬余受試者的接種及期中數據分析。Ⅲ期臨床試驗期中分析數據結果顯示:在單針接種疫苗28天后,疫苗對所有癥狀的總體保護效力為65.28%;在單針接種疫苗14天后,疫苗對所有癥狀總體保護效力為68.83%。疫苗對重癥的保護效力分別為:單針接種疫苗28天后為90.07%;單針接種疫苗14天后為95.47%。Ad5-nCoV保護效力數據結果達到世界衛生組織相關技術標準及國家藥監局印發的《新型冠狀病毒預防用疫苗臨床評價指導原則(試行)》中相關標準要求。
中國首款單針接種新冠疫苗
Ad5-nCoV是全球首個進入臨床研究階段的新冠疫苗,分別于去年3月16日、4月12日在武漢啟動一期和二期臨床試驗。隨著近期在巴基斯坦、墨西哥等國陸續獲批緊急使用,Ad5-nCoV成為了國產第三款被大規模接種的新冠疫苗,其余兩款分別為國藥集團的新冠滅活疫苗(Vero 細胞)和科興中維的克爾來福。
與國藥集團和科興中維的滅活病毒疫苗不同,康希諾生物的Ad5-nCoV是腺病毒載體疫苗。傳統的滅活疫苗是將經滅活后的病毒微生物做為抗原,其產生的免疫效果維持時間相對較短,一般需要多次接種。腺病毒載體疫苗則是將病毒的部分基因序列插入腺病毒中,構建融合型病毒,激發機體的免疫反應,由于活病毒能夠在體內增殖,長時間和機體細胞產生作用,因此能夠誘導較強的免疫性。雖然腺病毒載體疫苗基因遞送效率高、激發的免疫性強,但與其他疫苗相比,其存在病毒載體潛在性安全風險、易受宿主固有受體影響等缺點。
康希諾生物的Ad5-nCoV是國內首款僅需單針接種的新冠疫苗,接種程序簡單,在相同產能下能夠保護更多的人群;同時超過90%的重癥預防率可極大地減輕各級醫療機構的壓力。此外,新冠疫苗通常對運輸和儲藏條件要求較高,而Ad5-nCoV在2至8℃條件下儲存即可,便于運輸和儲藏。
預虧4億、巨資研發,康希諾能否打出盈利“翻身仗”
康希諾生物于2009年成立,2020年8月13日登陸科創版,成為科創板開板以來首只“A+H”疫苗股。
在康希諾發布的2020年年度業績預告公告中顯示,公司預計2020年年度實現歸屬于母公司所有者的凈利潤為-4億元到-4.3億元,與上年同期相比,虧損增加2.4億元到2.7億元,同比增加155.13%到174.27%;預計2020年年度發生的研發費用為4.4億元到4.7億元,與上年同期相比,增加2.9億元到3.2億元,同比增加189.96%到209.73%。
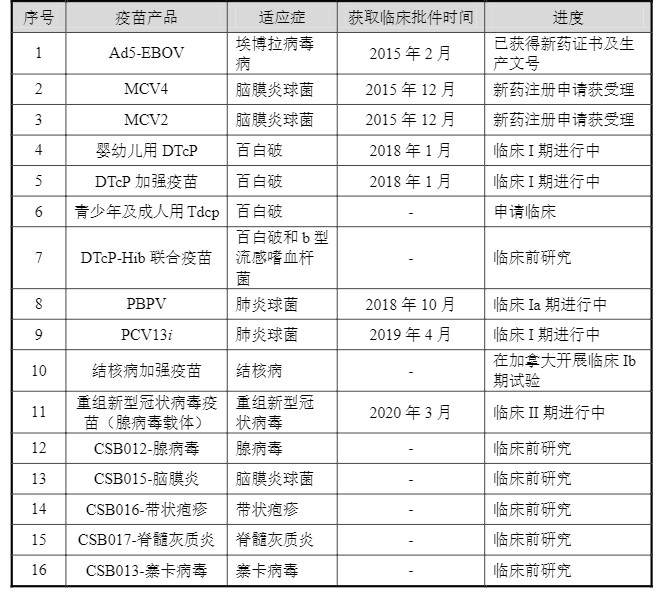
康希諾生物分別針對預防腦膜炎、埃博拉病毒病、百白破、肺炎、結核病、重組新型冠狀病毒疫苗(腺病毒載體)、帶狀皰疹等13個適應癥的16種創新疫苗產品的研發,其中適應于埃博拉病毒的Ad5-EBOV處于以獲得新藥證書及生產文號階段。這意味著目前康希諾尚無可提供收入的主力產品上市。
康希諾16種創新疫苗產品
2020年3月,Ad5-nCoV率先進入臨床研究階段,康希諾生物的市值水漲船高,從百億級別進軍到千億市值。也正是在新冠疫苗領域的研發投入,致使康希諾生物2020年度的虧損進一步擴大。2月18日,康希諾-U-B(06185.HK)跌幅一度擴大至10%,收跌9.35%,收報393.60港元/股。
這一切終于迎來了轉折。在巴基斯坦、墨西哥等國陸續獲批緊急使用后,康希諾生物的Ad5-nCoV附條件上市申請獲國家藥監局受理,Ad5-nCoV若成功上市,其1針接種程序的優勢將逐步呈現,可大幅減輕社會所支付的成本和醫療機構的負擔;對于康希諾而言,這也將是其迎來產品商業化、實現規模收入的第一步。
據推算,新冠疫苗僅國內市場就可能產生高達168億元利潤。此外中國正向53個發展中國家提供疫苗援助,并與22個國家達成了疫苗出口協議,從全球來看,我國企業的新冠疫苗市場空間可能達到千億以上。截至2月21日,國藥集團研制的新冠病毒疫苗在世界范圍內已經使用了超過4300萬劑,印尼也與中國達成了訂購1.25億劑科興疫苗的交易。
康希諾天津廠區設計產能 2 億劑/年,按每支15元的利潤計算,康希諾2021年新冠疫苗的利潤將達到30億人民幣,銷售額則高達百億人民幣。此外,康希諾的腦膜炎疫苗MCV4、MCV2將在2021年步入商業化階段,MCV4的產品力競爭優勢明顯但接種費用較高(1350元),預計MCV4整體滲透率在30%,將占據50%市場份額,對應銷售峰值32億元。因此36氪認為,康希諾預虧4億,2021年有望在新冠疫苗、MCV4、MCV2 商業化帶動下有望實現扭虧為盈;隨著肺炎疫苗、百白破疫苗、結核病加強疫苗等研發管線的陸續商業化,銷售收入有望達到百億級別。
百年一遇的彎道超車機會
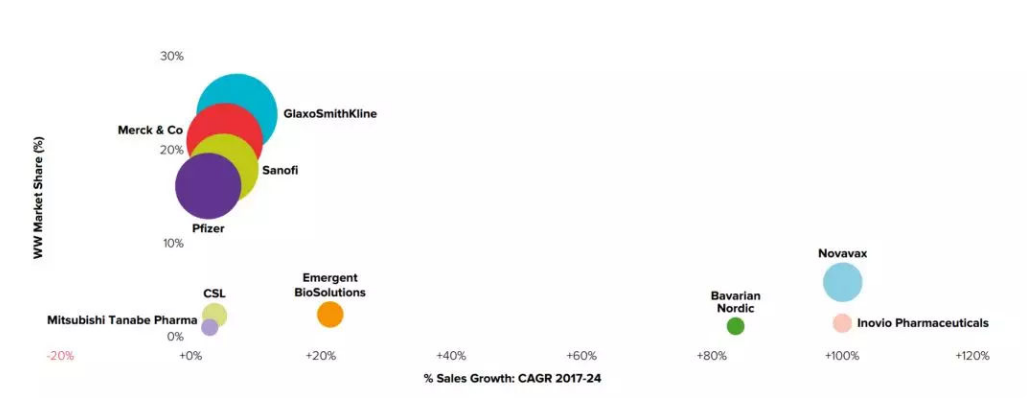
全球疫苗市場中,歐美接種意識成熟,市場占比超過60%;中國則屬于疫苗的新興市場,疫苗品種和接種率都相對處于初級水平,還有很多的市場空白。全球競爭格局也是寡頭競爭,幾乎是葛蘭素史克、賽諾菲巴斯德、默沙東、輝瑞這四家總部位于歐美的藥企瓜分天下,占據全球90%的市場份額(數據來源于高特佳投資)。
疫苗行業競爭壁壘高,臨床后期階段通常需要高達數億美元的高額成本。大型藥企具備雄厚的財力資源,它們成熟的商業化團隊也可以建立全球產能、加速搶占市場;而新銳公司則與之相反,很難從四大疫苗巨頭的手中挖到機會。
預測2024年全球疫苗市場份額,資料來源World Preview 2018、Outlook to 2024,圖片來源于高特佳投資官網
然而新冠疫苗的這場角逐,似乎給了康希諾等中國生物公司一個千載難逢的彎道超車機會。全球最早進入臨床的8款疫苗中,中國占了4個席位,分別是:軍事科學院軍事醫學研究院陳薇院士和康希諾生物聯合研發的重組新冠病毒(腺病毒載體)疫苗、北京科興中維生物技術有限公司研制的新型冠狀病毒滅活疫苗、國藥集團旗下武漢生物制品研究所以及北京生物制品研究所分別研制的新冠滅活疫苗。
創新疫苗研發的核心難度有三:“時間漫長、投入高昂、成功率低”。而對于本次新冠疫情這場突發公共衛生事件,各地行政機構紛紛給予政策支持,幫助縮短疫苗研發周期;此外,據推算,新冠疫苗的研發費用相比于其他創新藥物體量較低,可能為國內各新銳公司帶來了難得一遇的彎道超車機會。
為了盡快阻斷疫情蔓延,行政機構在盡量縮短研發周期,時間成本相比正常藥物已經壓縮到極致。這種縮短研發周期的方式,通常有減少臨床試驗入組患者數量、同情用藥、加速審批、有條件批準等等。
2020年3月,國家市場監管總局公布《藥品注冊管理辦法》和《藥品生產監督管理辦法》,明確疾病預防、控制急需的疫苗和創新疫苗可申請優先審批。國家藥監局在2月19日的就食品藥品安全“四個最嚴”專項行動相關問題答記者問中透露,已附條件批準我國2個新冠病毒疫苗上市,應急批準5條技術路線共16個疫苗品種開展臨床試驗,其中6個疫苗品種已開展Ⅲ期臨床試驗。近日,泰國、阿根廷、菲律賓等國也先后批準緊急使用中國科興和國藥集團的新冠疫苗。
CEPI(流行病預防創新聯盟)正在資助全球8個領先的新冠候選疫苗進臨床試驗,目標是到2021年至少有3個候選疫苗提交上市申請。根據它的調查測算,為了實現這個目標,需要投入約20億美元。依據新康界的推算,按成功率平攤下來,研發成本在3.792億美元-6.750億美元之間。橫向看H1N1/H5N1流感疫苗研發費用,估算結果為3.725億美元,接近新冠疫苗研發的最低成本。這個資金投入量,與動輒10-20億美元的其他創新藥物相比,體量還是比較低的。
數據來源:WHO,發展研究中心
來源:生活資訊網



評論前必須登錄!
立即登錄 注冊